Sıcaklık rejimi, her şeyden önce, donma işleminin hızını belirler.
Pozitif ve negatif değerler aralığındaki sıcaklık, reaksiyon hızını, bileşiklerin çözünürlüğünü, çözünme hızını, pıhtılaşmayı ve ayrıca ayrışmamış iyon çiftlerinin konsantrasyonunu etkiler. Çözeltilerde birkaç sıcaklık türü vardır: yapısal, donma noktası. Kristalleşme başlangıç sıcaklığı (donma noktası) - çözeltinin soğutulması sonucunda kristal oluşumunun başladığı sıcaklık. Donma noktasının düşürülmesi ΔТз, saf bir çözücünün donma noktası ile bir çözelti arasındaki farktır. Tuzlu suyun donma noktası her zaman saf suyun donma noktasından daha düşüktür ve çözünmüş tuzların konsantrasyonuna bağlıdır. Tuzlu sular için bu bağımlılık şu denklemle ifade edilebilir:
nerede İle- orantılılık katsayısı; İle bir çözeltideki çözünenin konsantrasyonudur.
Daha az seyreltik çözeltilerde, kristalleşme başlangıç sıcaklığı, ilgili sistemin durum diyagramından belirlenir. Deniz sularının ve yüksek mineralli doğal tuzlu suların donma sıcaklıkları farklı olacağından, bu sıcaklığın farklı formüller kullanılarak hesaplanması gerektiğini varsayıyoruz.
Çalışmada kullanılan sofra tuzu, deniz suyu ve doğal tuzlu su çözeltilerinin donma noktalarına ilişkin deneysel verilerin yaklaşıklığını yaptık. Donma sıcaklığı değişikliklerinin grafik ve analitik formlardaki bağımlılıkları Şekil 41-43'te sunulmaktadır.
Pirinç. 41. Donma noktasının bir tuz çözeltisinin tuzluluğuna bağımlılığı
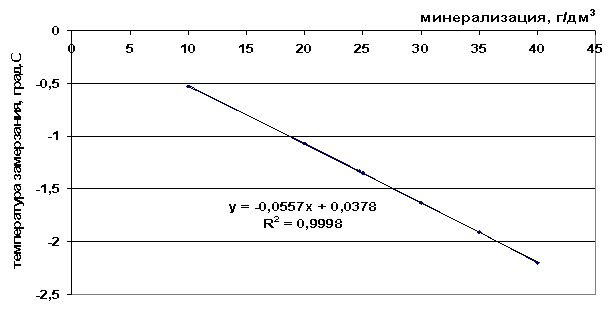
Pirinç. 42. Deniz suyunun donma noktasının tuzluluğa bağımlılığı
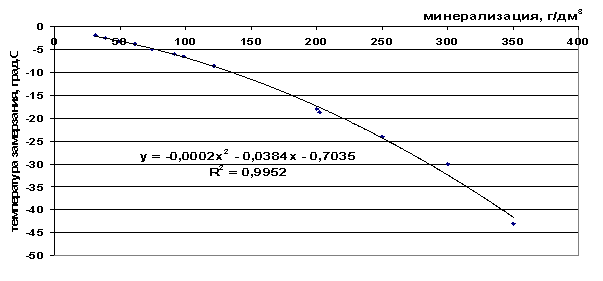
Pirinç. 43. Tuzlu suyun donma noktasının tuzluluğa bağımlılığı
Sunulan donma noktası değerlerinden (Tablo 9), çözeltinin toplam tuzluluğu arttıkça ve donmuş sisteme dahil edilen bileşenlerin sayısı arttıkça donma noktasının düştüğü görülebilir - ΔТз(NaCl)< ΔТз(морск.вода) < ΔТз(рассол).
Tablo 9. Oluşturulan grafiksel bağımlılıkların analizi
|
Ctot, g/dm 3 |
Donma noktası, °С |
||
|
NaCl çözeltisi |
deniz suyu |
||
|
t=8∙10 -5 M 2 -0.0945M+1.0595, |
0.0557M+0.0378, |
t=-2∙10 -4 M 2 -0.0384M-0.7035, |
|
* R 2 - yaklaşıklığın güvenilirliği
Tuzu giderilmiş sudan ayrı tuzların dondurulmasının farklı sıcaklıklarda, örneğin -2°C'lik bir sıcaklıkta meydana geldiği bilinmektedir, kalsiyum karbonat çökelmektedir. - 3.5 ° C'de sodyum sülfat. Sıcaklık -20 ° C'ye düştüğünde, sofra tuzu - 25.5-26 ° C'ye kadar magnezyum klorürler ve çok düşük sıcaklıklarda - 40-55 ° C'ye potasyum ve kalsiyum klorürler çöker. Negatif sıcaklıklar için, 0°C'nin altındaki sıcaklıklarda kararsız olan kristalli hidratların oluşum süreci spesifiktir. Örneğin, hidrohalit NaCl*2H 2O -0.15 °C'de oluşur, MgCl 2*12H2O -15 °C'de stabildir ve MgCl 2*8H2O 0 °C'nin altındadır, Na2CO 3*7H 2 O sadece -10°C'de oluşur. KCl 0°С'de KCl formunda kristalleşir, -6.6°С'de zaten iki faz bir arada bulunur - KCl ve KCl*H 2 O, -10,6°С'de sadece KCl*H 2 O çökelir Negatif bir sıcaklıkta, bireysel kristal belirli bir değerdeki koordinasyon sayılarına ve bunların karışımlarına göre (ancak karışık kristaller değil) mümkün olan maksimum sayıda kristalizasyon suyu molekülü ile hidratlar. Konsantre çözeltilerin donma noktasında anormal bir düşüş kaydedilmelidir.
"Doğa Tarihi Akademisi" yayınevinin yayınladığı dergileri dikkatinize sunuyoruz.
